Microscopio a forza atomica


Il microscopio a forza atomica (spesso abbreviato in AFM, dall'inglese atomic force microscope) è un microscopio a scansione di sonda (SPM) inventato da Gerd Binnig, Calvin Quate e Christoph Gerber nel 1986.[1]
Oltre a essere utilizzato come mezzo d'indagine, è anche uno dei principali strumenti di manipolazione della materia su scala nanometrica.
Principio di funzionamento[modifica | modifica wikitesto]

Il microscopio a forza atomica consiste di una microleva (cantilever) alla cui estremità è montata una punta acuminata (tip), tipicamente composta di silicio o nitruro di silicio, che presenta un raggio di curvatura dell'ordine dei nanometri.
La punta investigatrice viene collocata nelle strette vicinanze della superficie del campione di cui si vuole effettuare la scansione. La forza di van der Waals che agisce tra la punta ed il campione provoca una deflessione della microleva (la cui costante elastica è nota), in accordo con la legge di Hooke.
La deflessione della leva viene misurata utilizzando un punto laser riflesso dalla sommità della microleva verso una matrice di fotodiodi. Tuttavia, un sistema di rilevamento laser può essere costoso ed ingombrante; un metodo alternativo per determinare la deflessione della microleva consiste nell'utilizzare sonde AFM piezoresistive. Queste sonde sono fabbricate con elementi piezoresistivi che fungono da estensimetri a resistenza. Le deformazioni della sonda del microscopio a forza atomica dovute alla deflessione possono essere misurate utilizzando un ponte di Wheatstone, ma questo metodo non è altrettanto preciso di quello a deflessione laser.
Se la punta fosse esplorata ad altezza costante, si correrebbe il rischio che essa possa collidere con la superficie, danneggiandola. Di conseguenza, nella maggior parte dei casi viene utilizzato un meccanismo di retroazione per regolare la distanza tra la punta e il campione al fine di mantenere costante la forza che agisce tra loro. Generalmente il campione è collocato su un tubo piezoelettrico, che può spostarlo in direzione perpendicolare (direzione z) per mantenere una forza costante e nel piano (direzioni x ed y) per analizzarne la superficie. La mappa risultante s(x,y) rappresenta la topografia della superficie campione.
Modi di funzionamento[modifica | modifica wikitesto]
Il microscopio a forza atomica presenta tre principali modi di funzionamento: misura di forza, imaging, e manipolazione.
Le misure di forza permettono di valutare le forze presenti tra punta e campione in funzione della loro distanza. Questo metodo di funzionamento può essere applicato durante misure di spettroscopia di forza per misurare determinate proprietà del campione, come il modulo di elasticità (modulo di Young). In particolare, la spettroscopia di forza misura l'interazione e le forze di legame tra singole molecole, sfruttando forze meccaniche di stiramento o torsionali.
L'imaging si basa sul fatto che la forza di interazione tra punta e campione possa essere utilizzata per formare un'immagine tri-dimensionale (topografia) della superficie del campione ad alta risoluzione[2][3]. L'immagine topografica viene costruita registrando la posizione del campione rispetto alla punta e registrando l'altezza della sonda mantenendo costante l'interazione tra la punta e il campione. La topografia della superficie è comunemente visualizzata tramite un grafico a falsi colori.
Nei metodi di manipolazione, è possibile cambiare le proprietà del campione in maniera controllata sfruttando le forze tra la punta e il campione. La manipolazione può avvenire a livello atomico e viene utilizzata in applicazioni come la litografia a scansione di sonda o per la stimolazione di cellule.
Oltre all'acquisizione della topografia del campione, possono essere contemporaneamente misurate, ad alta risoluzione, diverse proprietà locali. Esempi interessanti sono sia proprietà meccaniche quali la rigidità del campione o le forze di adesione, che proprietà elettriche, come la conduttività o il potenziale della superficie.
Altre tecnologie[modifica | modifica wikitesto]
La principale differenza tra l'AFM e le altre tecnologie di microscopia, come microscopie ottiche e elettroniche, é data dal fatto che l'AFM non utilizza né lenti né irradiazione da fasci. Pertanto la risoluzione spaziale non è limitata da diffrazione o aberrazione spaziale e non é necessario lavorare in vuoto o colorare il campione.
I tipi di microscopia a scansione, oltre ad includere la microscopia a scansione di sonda (in cui sono comprese AFM, microscopio a effetto tunnel (STM) e near-field scanning optical microscope (SNOM/NSOM), STED microscopy (STED), microscopio elettronico a scansione e l'AFM elettrochimico (EC-AFM). Sebbene SNOM e STED utilizzino luce visible, infrarosso o anche terahertz per illuminare il campione, la risoluzione di tali tecniche è limitata dal limite di diffrazione.
Configurazione[modifica | modifica wikitesto]
In Fig. 3 é mostrato uno schema del funzionamento della AFM.[4] I numeri nelle parentesi corrispondono ai numeri indicati nell'immagine. Il sistema di coordinate è indicato in figura (0).
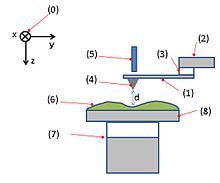
(1): Cantilever, (2): supporto del cantilever, (3): Elemento piezoelettrico (permette al cantilever di oscillare alla sua auto frequenza), (4): Punta (fissata alla fine aperta del cantilever, funziona come sonda), (5): Detector di deflessione e movimento del cantilever, (6): campione da misurare, (7): movimento xyz, (muove il campione (6) e il supporto (8) nelle direzioni x, y, e z rispetto alla punta(4)), e (8): supporto.
Un cantilever (1) di piccole dimensioni, modellizzabile come una molla, è situato sul supporto (2). Un elemento piezoelettrico (tipicamente fatto di un materiale ceramico) (3) può, a seconda del modo di acquisizione scelto, far oscillare il cantilever (1). Una punta aguzza (4) è posizionata alla fine della parte libera del cantilever (1). Il detector (5) registra la deflessione e il moto del cantilever (1). Il campione (6) é montato su un portacampioni (8). Il movimento xyz (7) permette di muovere sia il campione (6) che il portacampioni (8) nelle direzioni x, y, e z rispetto alla sommità della punta (4).Sebbene la Fig. 3 mostri i comandi per il movimento vicini al campione, essi possono anche essere situati vicino alla punta o comandi indipendenti possono essere attaccati ad entrambi, dal momento che in alcuni sistemi vanno controllati sia lo spostamento fine della punta che del campione. I comandi per controllare lo strumento e per fare le immagini non sono mostrati in Fig.3.
In accordo con la configurazione mostrata sopra, l'interazione tra la punta e il campione, che é un fenomeno su scala atomica registrato tramite spostamenti del cantilever, é tradotto su scala macroscopica. Molti parametri relativi al cantilever possono essere utilizzati per quantificare l'interazione tra punta e campione. La deflessione del cantilever è la più utilizzata, ma si possono ottenere informazioni anche dall'ampiezza dell'oscillazione imposta sul cantilever o da cambiamenti della frequenza di risonanza del cantilever.
Detector[modifica | modifica wikitesto]
Il detector (5) dell'AFM misura la deflessione del cantilever rispetto alla posizione dei equilibrio e la converte in un segnale elettrico. Le intensità del segnale sono proporzionali allo spostamento del cantilever.
Per l'acquisizione del segnale, sono utilizzati diversi metodi, quali l'nterferometria, metodi piezoresistivi e piezoelettrici.
Formazione dell'immagine[modifica | modifica wikitesto]
Nota importante: Per il seguente paragrafo, viene considerata la modalità "a contatto" (per ulteriori informazioni si consiglia la lettura della sezione Modalità di acquisizione). Per gli altri metodi di acquisizione, il procedimento è simile, eccetto per il fatto che il termine che indica la "deflessione" dovrebbe essere rimpiazzato da un'appropriata variabile di feedback.
Quando viene utilizzato il microscopio AFM per acquisire la morfologia di un campione, la punta è portata a contatto con il campione. Il campione stesso è scansito lungo una griglia nelle direzioni x e y.(fig 4). Solitamente viene impiegato un circuito di feedback elettronico, per mantenere la forza tra la punta ed il campione costante durante la scansione. La variabile di ingresso di tale circuito è la deflessione del cantilever e la variabile in uscita è il controllo sulla distanza, lungo -asse z, tra la punta ed il supporto (rispettivamente 2 e 8 nella fig. 3). Finché la punta rimane a contatto con il campione e la scansione avviene lungo il piano x,y, le variazioni in altezza del campioni si traducono in movimenti del cantilever. Il feedback, a questo punto, riporta l'altezza del supporto della punta ad un valore predeterminato dall'utente, chiamati setpoint. Il circuito di feedback ha quindi il compito di monitorare la distanza di separazione tra il supporto e il campione durante la scansione, in modo che la deflessione rimanga circa costante. In questa configurazione, il feedback rappresenta la topografia della superficie, entro piccoli errori.
Storicamente, è stato utilizzato un altro metodo, in cui la distanza tra la punta e il supporto per il campione è mantenuta costante e non è controllata da un circuito di feedback (servomeccanismo). In questo metodo, solitamente chiamato "modo ad altezza costante", la deflessione del cantilever è registrata come una funzione delle posizioni in x e y del cantilever. Finché la punta rimane a contatto con il campione, la deflessione corrisponde alla topografia della superficie. La principale ragione per cui questo metodo non viene più utilizzato risiede nel fatto che le forze tra il campione e la punta non possono venire controllate e, se troppo intense, possono danneggiare la punta o il campione. In ogni caso, è pratica comune che, anche in questa modalità, venga registrata la deflessione del cantilever. Infatti quest'ultima può rivelare piccoli errori nella tracciatura del feedback o rivelare elementi che il feedback non è in grado di rilevare.
Il segnale AFM, che si tratti di quello di altezza o della deflessione del cantilever, è registrato da un computer durante la scansione. Le immagini sono create in falsi colori, in cui ciascun pixel rappresenta la posizione in x e y e i colori il segnale registrato.

(1): Apice della punta, (2): Superficie del campione, (3): traiettoria lungo Z dell'apice della punta, (4): Cantilever.
Storia[modifica | modifica wikitesto]
Il microscopio a forza atomica è stato inventato da scienziati IBM, tra cui Binnig, nel 1982.[5] Binnig, insieme a Rohrer, aveva precedentemente inventato il microscopio a effetto tunnel all'inizio del 1980 nel centro di ricerca IBM Research - di Zurigo. Per tale invenzioni, Binnig e Rohrer ottennero il Premio Nobel per la fisica nel 1986. Nello stesso anno, venne realizzata la prima versione sperimentale del microscopio AFM da Binnig, Quate e Gerber.[6]
La prima versione commerciale venne distribuita nel 1989. Ad oggi è uno dei microscopi più utilizzati per misurare, acquisire immagini e manipolare la materia alla nanoscala.
Applicazioni[modifica | modifica wikitesto]
L'AFM può essere utilizzato per una vasta gamma di discipline appartenenti al ramo delle scienze naturali. Fra tutte, sono particolarmente rilevanti la fisica dello stato solido, la scienza e tecnologia dei semiconduttori, l'ingegneria molecolare, la chimica e la fisica dei polimeri, la chimica di superficie, la biologia cellulare e la medicina.
Tra le applicazioni al campo della fisica dello stato solido sono di notevole importanza l'identificazione di atomi sui diversi substrati, la valutazione delle interazioni tra un atomo specifico e gli atomi vicini e lo studio dei cambiamenti nelle proprietà fisiche derivate dalla manipolazione di atomi.
In biologia molecolare, l'AFM può essere utilizzata per studiare la struttura e le proprietà meccaniche di proteine complesse e insiemi di proteine: è stata infatti utilizzata per immagini topografiche e misure di durezza di microtuboli, proteine e Batteriorodopsina.
In biologia cellulare viene invece utilizzata per distinguere cellule affette da cancro da cellule sane, basandosi sulla differenza di modulo di Young. Viene inoltre impiegata per valutare l'interazione tra una cellula specifica e le cellule vicine. Un altro modo di utilizzo è l'indentazione delle cellule, per studiare come cambia la durezza e la forma della membrana della cellula.
Alcuni particolari tipi di cantilever conduttivi permettono di valutare i potenziali elettrici. In particolare alcuni sistemi permettono di registrare i cambiamenti di corrente che scorre nella punta per valutare la conduttività elettrica o le proprietà di trasporto.[7]
Modi di acquisizione[modifica | modifica wikitesto]
Nel corso degli anni, sono stati sviluppati diversi modi di funzionamento per il microscopio ad interazione atomica. I tre principali modi di funzionamento sono distinti a seconda del tipo di moto della punta, ovvero il modo statico, o contact mode, e due modi dinamici, il tapping mode ed il non-contact mode. Il tapping mode viene definito come metodo di acquisizione a contatto intermittente (o AC) oppure AFM a modulazione di ampiezza dal meccanismo di acquisizione. Allo stesso modo il non-contact mode viene anche definito AFM a modulazione di frequenza, dal meccanismo di acquisizione dell'immagine.
Funzionamento a contatto statico[modifica | modifica wikitesto]
Nel funzionamento a contatto statico, la forza agente tra la punta e la superficie campione viene mantenuta costante durante la scansione, mantenendo una deflessione costante utilizzando direttamente il segnale di feedback. Dal momento che la misura di un segnale statico è affetta da rumore e drift, sono consigliati cantilever con una costante di oscillazione della molla bassa, in maniera che la loro rigidità sia ridotta. In questo modo si riesce ad ottenere un segnale di deflessione abbastanza grande, mantenendo le forze di interazione basse. Infatti vicino al campione, le forze di interazione possono essere abbastanza elevate, tanto da causare l'effetto di "snap-in", ovvero la punta si incolla alla superficie. Pertanto il funzionamento a contatto viene fatto ad un'altezza per cui la forza rimane repulsiva per tutta la lunghezza del campione.
Funzionamento a contatto dinamico[modifica | modifica wikitesto]

In condizioni ambientali, tra la punta e la maggior parte dei campioni si forma un menisco d'acqua, dovuto all'umidità. In queste condizioni, mantenere la punta ad altezza costante rispetto al substrato (contact mode) può risultare complicato e può risultare in un incollamento della punta alla superficie studiata. Per arginare tale problema, vennero sviluppati i due metodi a contatto dinamico, il non-contact mode e il tapping mode.[9] Ad oggi, il sistema più utilizzato è il metodo "tapping" sia per lavorare in ambienti liquidi che in aria, soprattutto per studiare sistemi delicati quali le proteine.
Nel modo tapping, il cantilever viene messo in oscillazione vicino alla sua frequenza di risonanza. L'oscillazione viene comunemente ottenuta tramite un piezoelettrico situato nella struttura che regge il cantilever. L'oscillazione può anche essere ottenuta includendo campi magnetici AC (per cantilever magnetici), cantilever piezoelettrici o riscaldamento periodico della punta con un fascio laser modulato. L'ampiezza di oscillazione può variare da pochi nm a 200 nm. La frequenza e l'ampiezza del segnale sono mantenuti costanti, portando ad un'oscillazione del cantilever costante finché non ci siano effetti di drift o di interazione con la superficie. Diverse forze di interazione entrano in gioco quando la punta si avvicina al campione, tra cui forze di Van der Waals, interazioni dipolo-dipolo, forze elettrostatiche, ecc. L'ampiezza di oscillazione, in presenza di tali forze, causa un cambiamento nell'ampiezza di oscillazione del cantilever mentre la punta si avvicina al campione. Tale ampiezza viene usata come uno dei parametri che controllano un servo elettronico tramite il quale viene controllata l'altezza del cantilever rispetto al campione, in maniera da mantenere l'ampiezza di oscillazione del cantilever costante durante la scansione.
Sebbene la forza applicata al campione dalla punta risulti più intensa rispetto al funzionamento a contatto, il funzionamento in tapping mode genera un danno minore sul campione. Questo fatto è generalmente spiegato dalla breve durata dell contatto durante l'impulso.
È possibile inoltre monitorare e registrare anche la fase dell'oscillazione. Tale segnale contiene informazioni riguardanti l'energia dissipata dal cantilever ad ogni ciclo di oscillazione. L'informazione che è possibile ricavare riguarda sia cambiamenti riguardanti la durezza del campione sia diverse proprietà di adesione, non visibili nell'immagine topografica. Tali informazioni sono tuttavia qualitative: l'estrazione di informazioni quantitative è spesso impossibile.
Non-contact mode[modifica | modifica wikitesto]
In questa modalità, la punta non entra mai in contatto con la superficie. Il cantilever oscilla alla propria frequenza di risonanza (modulazione di frequenza) o appena sopra (modulazione di ampiezza). Solitamente l'oscillazione varia da pochi nanometri (<10 nm) a pochi picometri.[10] Le forze di van der Waals, che vengono esercitate ad una distanza da 1 nm a 10 nm dalla superficie, o altre forze a lungo raggio fanno sì che la risonanza del cantilever venga smorzata. L'ampiezza di oscillazione e la frequenza sono mantenute costanti grazie sia al cambio di frequenza di risonanza (che diminuisce) sia al circuito di feedback, che fanno sì che la distanza tra punta e campione rimanga costante. La misura della distanza tra la punta e il campione permette di costruire l'immagine della superficie del campione.
Modulazione di frequenza e modulazione di ampiezza[modifica | modifica wikitesto]
Gli schemi per i funzionamenti ad assenza di contatto e a contatto dinamico includono la modulazione di frequenza e la più comune modulazione di ampiezza. Nella modulazione di frequenza le variazioni della frequenza di oscillazione forniscono informazioni riguardo alle caratteristiche della superficie campione. Dal momento che la frequenza può essere misurata con grande precisione, per avere maggiore stabilità nella misura vengono utilizzati cantilever molto rigidi. Grazie a questa caratteristica, tramite questa tecnica è stata raggiunta per la prima volta la risoluzione atomica in condizioni di ultra-alto vuoto.[11]
Nella modulazione di ampiezza, le variazioni nell'ampiezza di oscillazione producono informazioni topografiche della superficie campione. In aggiunta, le variazioni di fase delle oscillazioni nella modalità di modulazione di ampiezza possono essere usate per discriminare tra differenti tipologie di materiali sulla superficie. Questo metodo può essere utilizzato per entrambe le modalità dinamiche. Anche in questo caso, utilizzando cantilever molto rigidi e condizioni di ultra-alto vuoto è stata raggiunta la risoluzione atomica.
AFM in liquido[modifica | modifica wikitesto]
La tecnica AFM può essere utilizzata in ambiente liquido. Rispetto all'acquisizione in aria, la modalità a contatto (contact mode) non presenta particolari differenze, mentre l'acquisizione diventa più complessa nelle modalità non a contatto e tapping. La scelta tra metodi di acquisizione dinamico e non dinamico dipende dal campione da analizzare: se il campione é rigido e saldamente ancorato al substrato viene preferita la modalità a contatto, in caso di campioni biologici più soffici e fragili sono preferibili le modalità non a contatto o tapping.[12][13][14]
La scansione può avvenire, a seconda dello strumento utilizzato, muovendo la punta o il campione. Per le misure in liquido, è preferibile muovere la punta durante la misura, in maniera da evitare lo spostamento del liquido durante la scansione. Tuttavia muovere la punta comporta degli svantaggi, a partire dalla risoluzione dell'immagine più bassa, oltre ad un'instabilità termica maggiore.
Per alcune applicazioni risulta conveniente adottare il metodo classico di misura, ovvero muovere il campione rispetto alla punta, che rimane ferma durante la scansione. Questo minimizza l'instabilità termica nella cella, oltre a migliorare la qualità dell'immagine. In alcuni casi, si cerca di minimizzare il movimento del campione rispetto alla cella con il liquido, per evitarne fuoriuscite e diminuire il rumore, dovuto al movimento del liquido durante la scansione.
Un ulteriore aspetto da tenere in considerazione per quanto riguarda le modalità di acquisizione dinaniche è la differenza nella vibrazione del cantilever in aria e in liquido. Le differenze sono sia nell'ampiezza di vibrazione sia in una riduzione della frequenza di risonanza. Tale riduzione può essere spiegata sia a causa dell'ambiente liquido, più denso dell'aria e con una maggiore viscosità, sia dall'aumento della massa sul cantilever.[15]
Punta[modifica | modifica wikitesto]
La scelta della punta é un elemento fondamentale per tutti i tipi di scansione AFM, sia che si tratti di scansioni in aria che in liquido. Oltre alla geometria della punta e al tipo di campione, bisogna prestare particolare attenzione al materiale di cui è fatta la punta, nonché al ricoprimento, soprattutto in presenza di liquido e in ambiente acido.[12] I principali parametri che influenzano la scelta della punta sono:[16]
- il tipo di tecnica (contatto statico, contatto dinamico, assenza di contatto dinamico)
- il tipo di campione (se fragile o robusto)
- l'esperimento AFM (topografia, elettrica, magnetica ecc..,)
- la risoluzione e la durata della misura
I materiali solitamente utilizzati per la punta sono silicio, nitruro di silicio e vetro borosilicato. Il cantilever può essere dello stesso materiale della punta. I ricoprimenti vengono scelti a seconda delle diverse applicazioni: i più utilizzati sono oro[17], platino iridio (PtIr5), diamante[18] o ricoprimenti magnetici.
In particolare, la somma del segnale registrata dal fotodiodo deve rimanere sufficientemente alta in modo da ottenere una buona immagine. Tuttavia i dettagli strutturali e chimici della punta non sono sempre noti. Infatti, la caratterizzazione della punta è difficile e dispendiosa in termini di tempo, nonché molti dei metodi di caratterizzazione sono distruttivi per la punta stessa.
Le punte possono avere essere di diverse forme geometriche: generalmente le più diffuse sono di forma piramidale e colloidale.
In aria[modifica | modifica wikitesto]
Per le scansioni in aria sono ampiamente utilizzate punte in silicio, solitamente di forma conica. L'altezza della punta e la grandezza della parte terminale possono variare a seconda della risoluzione che si vuole ottenere e del tipo di immagine da acquisire. Solitamente sono comprese tra i ∼10-15 µm in altezza e 10 m o inferiore per quanto riguarda la sommità della punta. Le punte in silicio tuttavia, non possono essere utilizzate in liquido, a causa della rigidità del cantilever, che presenta un'alta costante elastica.
In liquido[modifica | modifica wikitesto]
In ambiente liquido, le forze di solvatazione giocano un ruolo fondamentale nell'acquisizione dell'immagine. I principali parametri da tenere in considerazione sono la composizione chimica della punta,[19] della geometria della parte terminale della punta[20] e della carica superficiale.[21]
Per questo motivo, sono ampiamente utilizzate punte in nitruro di silicio. Tali punte presentano una costante elastica del cantilever molto più bassa rispetto alle punte in silicio, permettendo sia la scansione in non contact e tapping mode, che la scansione in contact mode. Tali punte presentano una buona durata e soffrono meno l'usura rispetto alle punte in silicio. Tuttavia, due parametri geometrici di tali punve, ovvero la loro altezza (∼2,5 µm) e la loro scarsa spigolosità, solitamente attorno ai ∼20-60 nm, limitano la risoluzione.[22]
Recentemente sono state sviluppate delle punte ibride, in maniera da combinare i vantaggi di entrambe le tipologie. Queste punte presentano il cantilever in nitruro di silicio, più morbido, e la punta in silicio, in maniera che sia più aguzza, in maniera da aumentare la risoluzione dell'immagine. Questa tipologia di punta riduce l'effetto delle forze di solvatazione nel caso in cui il substrato analizzato sia sufficientemente piatto.[23]
Akrami et al.,[24] in un recente studio, hanno dimostrato che, utilizzando punte commerciali, è possibile ottenere immagini ad alta risoluzione creando siti di idratazione locale nella zona terminale della punta. In questo studio sono stati principalmente utilizzati campioni piatti. Tramite i siti di idarazione, si creano forze di interazione stabili tra punta e campione, aumentando riproducibilità e risoluzione dell'immagine. Un ulteriore vantaggio di tali siti viene dal fatto che la punta viene maggiormente protetta da eventuali contaminazioni esterne e rallenta l'invecchiamento. I siti di idratazione possono essere creati tramite sputtering di silicio o argon. Un possibile svantaggio di tale tecnica é dato, in caso di trattamenti esterni sulla punta, da eventuali effetti di convoluzione e arrotondamento della punta, che possono diminuire le prestazioni della stessa e, quindi, inficiare la risoluzione dell'immagine.[25]
Forza vs geometria della punta[modifica | modifica wikitesto]
La forza tra la punta e il campione dipende fortemente dalla geometria della punta. Negli anni passati sono stati fatti diversi studi per modellizzare l'effetto della punta sulle diverse forze di interazione.[26]
La forza dovuta al menisco d'acqua sulla superficie é certamente una delle più interessanti da studiare, ma non è l'unica forza in gioco per questi sistemi. Infatti sono da considerare anche la forza Coulombiana, le forze di van der Waals, le interazioni di doppio strato, le forze di solvatazione, di idratazione e idrofobiche.
Forza esercitata dal menisco di acqua[modifica | modifica wikitesto]
La forza esercitata dal menisco di acqua è di grande interesse per le misure AFM in aria. Infatti un sottile strato di acqua tra la punta e il campione é sempre presente in tali sistemi, dal momento che è dovuto all'umidità presente nell'atmosfera.[27] Tale fenomeno è anche interessante per le misure in liquido in cui, a maggior ragione, è presente il menisco di acqua.
Lo strato di acqua non influenza più di tanto le forze attrattive, mentre crea una forza di adesione tra la punta e il campione. A causa dell'alta energia superficiale, risulta particolarmente difficoltoso staccare la punta dalla superficie. Come esempio, viene riportato il calcolo per una punta conica e una sferica.
Per quantificare questa forza, si parte dalla equazione di Laplace per la pressione:
dove γL è l'energia superficiale e r1 e r0 sono definite in figura .
La pressione viene applicata sull'area A, definita come:

dove d, θ , e h sono definite in figura
La forza esercitata tra le due superficie è dunque:
La stessa formula può anche essere calcolata considerando l'umidità relativa.
Gao[28] ha calcolato tale formula per diverse geometrie del campione, dimostrando che la forza diminuisce del 20% per una punta conica rispetto ad una punta sferica.
Durante il calcolo delle forze bisogna distinguere tra due situazioni: asciutto su bagnato e bagnato su bagnato.
Per una punta sferica, la formula diventa:
per asciutto su bagnato
per bagnato su bagnato
dove θ è l'angolo di contatto della sfera asciutta e φ è l'angolo di immersione come mostrato in figura R,h e D sono mostrate nella stessa immagine.
Per una punta conica, la formula diventa:
per asciutto su bagnato
per bagnato su bagnato
dove δ è l'angolo di metà cono e r0 e h sono parametri del profilo del menisco.
Vantaggi[modifica | modifica wikitesto]

Il microscopio a forza atomica presenta diversi vantaggi rispetto al microscopio elettronico: diversamente da quest'ultimo, che fornisce una proiezione bidimensionale o un'immagine bidimensionale di un campione, l'AFM produce un reale profilo tridimensionale della superficie; inoltre i campioni analizzati da un microscopio ad interazione atomica (AFM) non richiedono nessun trattamento speciale (metallizzazione e grafitizzazione) che potrebbe modificare o distruggere irrimediabilmente il campione.
Mentre un microscopio elettronico per un funzionamento corretto necessita di un costoso ambiente sottovuoto, la maggior parte delle modalità operative del microscopio ad interazione atomica (AFM) funzionano perfettamente nell'ambiente normale o perfino in un ambiente liquido. Ciò lo rende un ottimo strumento per lo studio di macromolecole biologiche e di organismi viventi.
Svantaggi[modifica | modifica wikitesto]
Il principale svantaggio del microscopio a forza atomica rispetto al microscopio elettronico a scansione (SEM) consiste nelle dimensioni dell'immagine: il microscopio elettronico a scansione (SEM) è in grado di mostrare un'area dell'ordine del millimetro per millimetro e una profondità di campo dell'ordine del millimetro; il microscopio a forza atomica può invece riprodurre solo una profondità dell'ordine del micrometro ed un'area massima di circa 100 per 100 micrometri.
Un altro inconveniente di tale strumento è che l'elevata risoluzione e la qualità delle immagini sono limitate dal raggio di curvatura della sonda e una scelta errata della sonda può portare anche alla formazione di artefatti.
Inoltre tale microscopio non è in grado di analizzare le immagini velocemente come il microscopio elettronico a scansione: per effettuare la scansione di un'area ci vogliono tipicamente diversi minuti con un microscopio a forza atomica, mentre un microscopio elettronico a scansione (una volta effettuato il vuoto nella colonna) è in grado di esplorarla quasi in tempo reale (anche se con una qualità relativamente bassa). I lunghi tempi impiegati per formare l'immagine possono anche portare molto spesso al drift termico dell'immagine. Per questo motivo il microscopio a forza atomica può non rivelarsi adatto per misurare in modo accurato le distanze tra gli artefatti di tali immagini.
Infine molte immagini AFM sono caratterizzate dall'isteresi dei materiali piezoelettrici e dai disturbi nella trasmissione prodotta da alterazione o disordine nei segnali fra i diversi canali degli assi (x,y,z). L'immagine deve essere perciò post-processata e filtrata con un opportuno software.
Importanti passi in avanti sono stati effettuati con la progettazione del video-AFM, con il quale si possono ottenere delle immagini di buona qualità e in tempi inferiori a quelli del SEM.
Note[modifica | modifica wikitesto]
- ^ G. Binnig, Atomic Force Microscope, in Physical Review Letters, vol. 56, n. 9, 1º gennaio 1986, pp. 930-933, DOI:10.1103/PhysRevLett.56.930. URL consultato il 14 febbraio 2017.
- ^ (EN) Daniel J. Müller e Yves F. Dufrêne, Atomic force microscopy as a multifunctional molecular toolbox in nanobiotechnology, in Nature Nanotechnology, vol. 3, n. 5, 2008, pp. 261-269, Bibcode:2008NatNa...3..261M, DOI:10.1038/nnano.2008.100, ISSN 1748-3387.
- ^ (EN) Nagaraju Chada, Krishna P. Sigdel, Raghavendar Reddy Sanganna Gari, Tina Rezaie Matin, Linda L. Randall e Gavin M. King, Glass is a Viable Substrate for Precision Force Microscopy of Membrane Proteins, in Scientific Reports, vol. 5, n. 1, 31 luglio 2015, Bibcode:2015NatSR...512550C, DOI:10.1038/srep12550, ISSN 2045-2322.
- ^ Patent US4724318 - Atomic force microscope and method for imaging surfaces with atomic resolution
- ^ IBM's 35 atoms and the rise of nanotech.
- ^ Atomic Force Microscope, vol. 56, Bibcode:1986PhRvL..56..930B, DOI:10.1103/physrevlett.56.930, PMID 10033323.
- ^ K.M. Lang, D. A. Hite, R. W. Simmonds, R. McDermott, D. P. Pappas e John M. Martinis, Conducting atomic force microscopy for nanoscale tunnel barrier characterization, in Review of Scientific Instruments, vol. 75, n. 8, 2004, pp. 2726-2731, Bibcode:2004RScI...75.2726L, DOI:10.1063/1.1777388 (archiviato dall'url originale il 23 febbraio 2013).
- ^ AFM Single Molecule Experiments at the Solid−Liquid Interface: In Situ Conformation of Adsorbed Flexible Polyelectrolyte Chains, vol. 127, DOI:10.1021/ja0558239, PMID 16277495.
- ^ Fractured polymer/silica fiber surface studied by tapping mode atomic force microscopy, vol. 290, Bibcode:1993SurSL.290L.688Z, DOI:10.1016/0167-2584(93)90906-Y.
- ^ 10.1126/science.1176210, vol. 325, Bibcode:2009Sci...325.1110G, DOI:10.1126/science.1176210, PMID 19713523.
- ^ Advances in atomic force microscopy, vol. 75, Bibcode:2003RvMP...75..949G, DOI:10.1103/RevModPhys.75.949.
- ^ a b Kislon Voïtchovsky, High-resolution AFM in liquid: what about the tip?, in Nanotechnology, vol. 26, n. 10, 13 marzo 2015, p. 100501, DOI:10.1088/0957-4484/26/10/100501.
- ^ Imaging of biological samples in liquid environment, su ntmdt-si.com.
- ^ Constant A. J. Putman, Kees O. Van der Werf, Bart G. De Grooth, Niek F. Van Hulst, and Jan Greve, Tapping mode atomic force microscopy in liquid, in Appl. Phys. Lett, vol. 64, n. 2454.
- ^ M. Habibnejad Korayem, H. Jiryaei Sharahi e A. Habibnejad Korayem, Comparison of frequency response of atomic force microscopy cantilevers under tip-sample interaction in air and liquids, in Scientia Iranica, vol. 19, n. 1, 2012-02, pp. 106-112, DOI:10.1016/j.scient.2011.12.009. URL consultato il 15 giugno 2018.
- ^ Tip comparison, su spmtips.com.
- ^ Oscar H. Willemsen, Margot M.E. Snel, Alessandra Cambi, Jan Greve, Bart G. De Grooth and Carl G. Figdor "Biomolecular Interactions Measured by Atomic Force Microscopy" Biophysical Journal, Volume 79, Issue 6, December 2000, Pages 3267-3281.
- ^ Koo-Hyun Chung and Dae-Eun Kim, "Wear characteristics of diamond-coated atomic force microscope probe". Ultramicroscopy, Volume 108, Issue 1, December 2007, Pages 1-10
- ^ Paul D. Ashby, Liwei Chen e Charles M. Lieber, Probing Intermolecular Forces and Potentials with Magnetic Feedback Chemical Force Microscopy, in Journal of the American Chemical Society, vol. 122, n. 39, ottobre 2000, pp. 9467-9472, DOI:10.1021/ja0020613.
- ^ Shah H. Khan e Peter M. Hoffmann, Diverging Effects of NaCl and CsCl on the Mechanical Properties of Nanoconfined Water, in Journal of The Electrochemical Society, vol. 165, n. 3, 21 febbraio 2018, pp. H114–H120, DOI:10.1149/2.0391803jes.
- ^ Maria Ricci, Peter Spijker e Kislon Voïtchovsky, Water-induced correlation between single ions imaged at the solid–liquid interface, in Nature Communications, vol. 5, n. 1, 16 luglio 2014, DOI:10.1038/ncomms5400.
- ^ Voïtchovsky K1., High-resolution AFM in liquid: what about the tip?, in Nanotechnology, vol. 10, n. 26.
- ^ Gillian B. Kaggwa, Prathima C. Nalam, Jason I. Kilpatrick, Nicholas D. Spencer e Suzanne P. Jarvis, Impact of Hydrophilic/Hydrophobic Surface Chemistry on Hydration Forces in the Absence of Confinement, in Langmuir, vol. 28, n. 16, 10 aprile 2012, pp. 6589-6594, DOI:10.1021/la300155c.
- ^ S M R Akrami, H Nakayachi, T Watanabe-Nakayama, H Asakawa e T Fukuma, Significant improvements in stability and reproducibility of atomic-scale atomic force microscopy in liquid, in Nanotechnology, vol. 25, n. 45, 14 novembre 2014, p. 455701, DOI:10.1088/0957-4484/25/45/455701.
- ^ Carl Leung, Aizhan Bestembayeva, Richard Thorogate, Jake Stinson, Alice Pyne, Christian Marcovich, Jinling Yang, Ute Drechsler, Michel Despont, Tilo Jankowski, Martin Tschöpe e Bart W. Hoogenboom, Atomic Force Microscopy with Nanoscale Cantilevers Resolves Different Structural Conformations of the DNA Double Helix, in Nano Letters, vol. 12, n. 7, 29 giugno 2012, pp. 3846-3850, DOI:10.1021/nl301857p.
- ^ Editorial Board, in Surface Science Reports, vol. 33, n. 1-2, 1999, pp. iii, DOI:10.1016/s0167-5729(99)90010-9.
- ^ T. Thundat, X.-Y. Zheng e G.Y. Chen, Role of relative humidity in atomic force microscopy imaging, in Surface Science Letters, vol. 294, n. 1-2, 1993-09, pp. L939–L943, DOI:10.1016/0167-2584(93)91119-9. URL consultato il 15 giugno 2018.
- ^ Chao Gao, Theory of menisci and its applications, in Appl. Phys. Lett, vol. 71, n. 1801.
Bibliografia[modifica | modifica wikitesto]
- Q. Zhong, D. Innis, K. Kjoller, V.B. Elings, Surf. Sci. Lett. 290, L688 (1993).
- Nan Yao, Zhong Lin Wang, Handbook of microscopy for nanotechnology, Springer Science & Business, 2005. ISBN 1-4020-8003-4
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su microscopio a forza atomica
Wikimedia Commons contiene immagini o altri file su microscopio a forza atomica
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) Atomic Force Microscopy, su doitpoms.ac.uk.
| Controllo di autorità | GND (DE) 4333578-0 |
|---|

![{\displaystyle A\simeq 2\pi R\simeq [r_{eff}(1+\cos \theta )+h]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bdaec618f9921eea6a1fd6236e73ab4a6760bf83)





