Propano
| Propano | |
|---|---|
 | |
 | |
 | |
| Nome IUPAC | |
| Propano | |
| Nomi alternativi | |
| R290 | |
| Caratteristiche generali | |
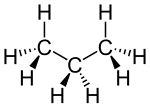
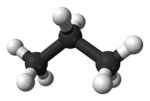
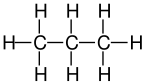
| Formula bruta o molecolare | C3H8 |
| Massa molecolare (u) | 44,09562 |
| Aspetto | gas incolore |
| Numero CAS | |
| Numero EINECS | 200-827-9 |
| PubChem | 6334 |
| SMILES | CCC |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,493 a 25 °C (allo stato liquido) |
| Densità (kg·m−3, in c.s.) | 2,0098 kg/m3 (a 0 °C, 101.3 kPa) |
| Indice di rifrazione | 1,2898 a 20 °C |
| Solubilità in acqua | 62,4 mg/L a 25 °C |
| Coefficiente di ripartizione 1-ottanolo/acqua | 2,36 |
| Temperatura di fusione | −187,6 °C (85,6 K) |
| ΔfusH0 (kJ·mol−1) | 3,52 |
| Temperatura di ebollizione | −42,1 °C (231,1 K) |
| ΔebH0 (kJ·mol−1) | 18,774 |
| Punto critico | 96,81 °C 42,01 atm |
| Tensione di vapore (Pa) a 298,15 K | 953206,24 |
| Indicazioni di sicurezza | |
| Punto di fiamma | −104 °C (vaso chiuso) |
| Limiti di esplosione | 2,1% - 9,5% (V) |
| Temperatura di autoignizione | 450 °C |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 220 - 280 |
| Consigli P | 210 - 410+403 [1] |
Il propano è un idrocarburo alifatico di formula CH3CH2CH3 appartenente alla serie degli alcani lineari saturi. A temperatura ambiente ed a pressione atmosferica standard (1 atm a 20-25 °C) il composto appare come un gas incolore ed inodore, che può essere tuttavia facilmente liquefatto per compressione. Poco solubile in acqua, acetone e parzialmente in etanolo a causa della sua natura apolare, risulta invece ben miscibile con dietiletere, cloroformio e benzene[2]. Il propano è presente in natura come componente del gas naturale e del petrolio grezzo, da cui viene estratto per distillazione frazionata, ed è inoltre il costituente principale del gas di petrolio liquefatto (GPL), miscela idrocarburica comunemente ottenuta dal petrolio largamente utilizzata come combustibile[3].
Sintesi[modifica | modifica wikitesto]
Trattandosi di un gas presente in natura, il propano non viene di norma sintetizzato industrialmente, ma è preferibilmente ottenuto per estrazione dal petrolio o dal gas naturale. Ad ogni modo esistono diverse reazioni che prevedono la formazione di propano come prodotto finale, come ad esempio l'idrogenazione del propilene[4]:
- CH3-CH=CH2 + H2 → CH3-CH2-CH3
Di seguito altre reazioni secondarie che portano alla formazione di propano[4]:
- CH3-CH2-CH2-X + H2 → CH3-CH2-CH3 + HX
- CH3-CH≡CH + 2H2 → CH3-CH2-CH3
- C3H7MgX + HX → CH3-CH2-CH3 + MgX2
Il composto rappresenta inoltre un comune residuo del processo di cracking degli idrocarburi pesanti, processo atto ad ottenere idrocarburi semplici a partire da molecole più complesse[3].
Reattività[modifica | modifica wikitesto]
La reazione più importante del propano è sicuramente la combustione, ovvero la reazione esotermica che prevede l'ossidazione del composto ad opera dell'ossigeno molecolare, il comburente per eccellenza[2]:
Utilizzi[modifica | modifica wikitesto]
Il propano trova svariati impieghi in molteplici ambiti, sia puro che in miscela, tendenzialmente con altri idrocarburi. Viene principalmente utilizzato come combustibile, come mezzo refrigerante (identificato dal codice R290) e come carburante in miscela con altre sostanze, prime tra tutte il butano. Oltre al suo utilizzo come carburante e refrigerante, Il composto trova impiego a livello industriale anche come solvente[5], come propellente e come intermedio di reazione nelle sintesi organiche. La relativa assenza di tossicità, inoltre, fa sì che la sostanza possa essere utilizzata anche in medicina come propellente per inalatori destinati alla somministrazione di principi attivi in forma di aerosol[2]. A causa del suo basso prezzo e abbondanza, la conversione del propano in monomeri (propilene, acido acrilico) è intensamente studiata[6][7][8][9][10][11][12].
Note[modifica | modifica wikitesto]
- ^ Propano - scheda di dati di sicurezza (PDF), su sigma-aldrich.com, Sigma-Aldrich. URL consultato il 23 settembre 2015.
- ^ a b c (EN) Propane, su HSDB, National Institutes of Health. URL consultato il 23 settembre 2015.
- ^ a b Propano, in Treccani.it – Enciclopedie on line, Roma, Istituto dell'Enciclopedia Italiana. URL consultato il 23 settembre 2015.
- ^ a b (EN) Propane, su webbok.nist.gov, NIST. URL consultato il 23 settembre 2015.
- ^ Ana B. Zanqui, Damila R. de Morais e Cláudia M. da Silva, Subcritical Extraction ofSalvia hispanicaL. Oil withN-Propane: Composition, Purity and Oxidation Stability as Compared to the Oils Obtained by Conventional Solvent Extraction Methods, in Journal of the Brazilian Chemical Society, 2014, DOI:10.5935/0103-5053.20140278. URL consultato l'11 maggio 2019.
- ^ (EN) Luz Amparo Palacio-Santos, Arnaldo Faro e Adriana Echavarría-Isaza, Oxidative dehydrogenation of propane with cobalt, tungsten and molybdenum based materials, in Revista Facultad de Ingeniería, vol. 0, n. 84, 25 settembre 2017, pp. 97–104, DOI:10.17533/udea.redin.n84a11. URL consultato l'11 maggio 2019 (archiviato dall'url originale il 22 aprile 2019).
- ^ Adriana Echavarría, Sandra Amaya e Johana Arboleda, NiZnFe and NiMgFe hydrotalcites modified with V and Cr as precusors of catalysts for oxidative dehydrogenation of propane [collegamento interrotto], in Ingeniería y competitividad, vol. 14, n. 2, 2012-12, pp. 169–178. URL consultato l'11 maggio 2019.
- ^ Luz Amparo Palacio, Adriana Echavarría e Juan Pablo Hernández, Synthesis of two new Nickel and Copper- Nickel vanadates used for propane oxidative dehydrogenation, in Revista Facultad de Ingeniería Universidad de Antioquia, n. 67, 2013-6, pp. 137–145. URL consultato l'11 maggio 2019 (archiviato dall'url originale il 28 febbraio 2019).
- ^ Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts, 2011.
- ^ The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts, in J. Catal., vol. 311, 2014, pp. 369-385.
- ^ Multifunctionality of Crystalline MoV(TeNb) M1 Oxide Catalysts in Selective Oxidation of Propane and Benzyl Alcohol, in ACS Catal., vol. 3, n. 6, 2013, pp. 1103-1113.
- ^ Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid, in J. Catal., vol. 285, 2012, pp. 48-60.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikizionario contiene il lemma di dizionario «propano»
Wikizionario contiene il lemma di dizionario «propano» Wikimedia Commons contiene immagini o altri file su propano
Wikimedia Commons contiene immagini o altri file su propano
Collegamenti esterni[modifica | modifica wikitesto]
- propano, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) propane, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 37767 · LCCN (EN) sh85107478 · GND (DE) 4047472-0 · BNF (FR) cb11944549c (data) · J9U (EN, HE) 987007541255705171 · NDL (EN, JA) 00569226 |
|---|

